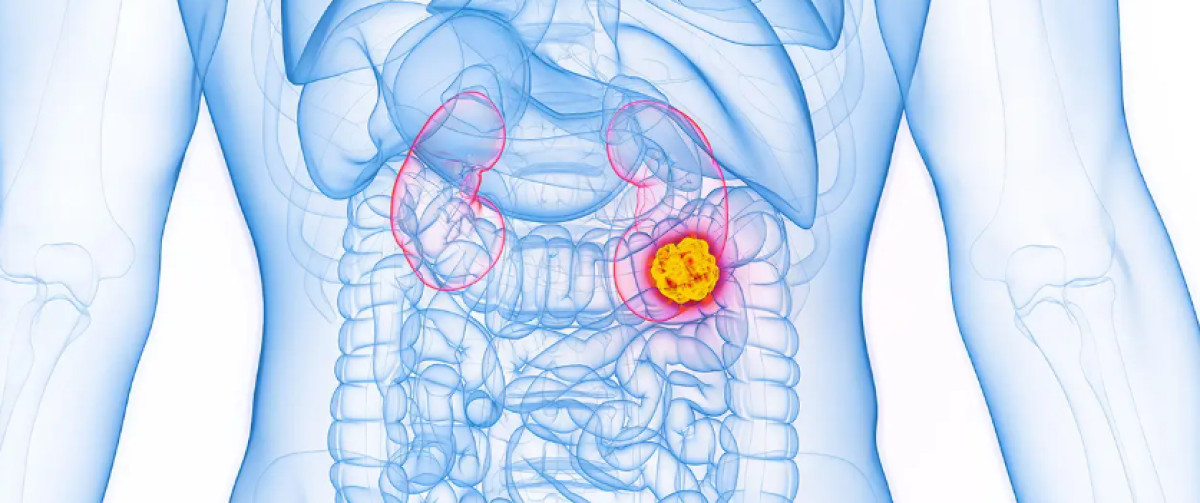
Ο FDA ενέκρινε το Belzutifan (Welireg) για το προηγουμένως θεραπευμένο προχωρημένο νεφροκυτταρικό καρκίνωμα (RCC), ανακοίνωσε ο οργανισμός.
Το Βelzutifan ενδείκνυται για ασθενείς με RCC με εξέλιξη της νόσου μετά από έναν αναστολέα του σημείου ελέγχου PD-1/L1 και έναν αναστολέα του VEGF( Vascular Endothelial Growth Factor-Αγγειακός ενδοθηλιακός αυξητικός παράγοντας) συνήθεις επιλογές πρώτης γραμμής για τη συγκεκριμένη νόσο. Το Belzutifan, ένας αναστολέας του επαγώγιμου παράγοντα υποξίας (HIF)-2α, είχε προηγουμένως εγκριθεί μόνο για όγκους που σχετίζονται με τον von Hippel-Lindau (είναι μια σπάνια γενετική διαταραχή με πολυσυστημική συμμετοχή).
Τα δεδομένα αποτελεσματικότητας και ασφάλειας από το LITESPARK-005 υποστήριξαν τη νέα ένδειξη. Στην ανοικτή μελέτη τυχαιοποιήθηκαν 746 ασθενείς που είχαν προχωρήσει μετά από έναν αναστολέα σημείου ελέγχου και έναν αναστολέα κινάσης τυροσίνης VEGF (TKI) σε θεραπεία μία φορά ημερησίως είτε με belzutifan είτε με everolimus (Afinitor).
«Παρά την πρόσφατη πρόοδο στη θεραπεία του προχωρημένου RCC, δεν υπάρχει ακόμη μια επιλογή που να έχει εγκριθεί ειδικά για ασθενείς των οποίων η νόσος εξελίσσεται μετά από θεραπεία με αναστολέα PD-1 ή PD-L1 και TKI», δήλωσε ο ερευνητής Toni Choueiri, MD, του Ινστιτούτου Καρκίνου Dana-Farber στη Βοστώνη, σε ένα δελτίο Τύπου από τη φαρμακοβιομηχανία Merck. «Αυτή η έγκριση του belzutifan εισάγει μια σημαντική νέα θεραπευτική επιλογή για ορισμένους ασθενείς, καθώς το Βelzutifan μείωσε τον κίνδυνο εξέλιξης της νόσου ή θανάτου σε σύγκριση με το everolimus».
Μείωση του κινδύνου θανάτου κατά 25%
Στη δοκιμή, το belzutifan μείωσε τον κίνδυνο εξέλιξης ή θανάτου κατά 25% σε σχέση με το everolimus (HR 0,75, 95% CI 0,63-0,90), αν και οι μέσες τιμές επιβίωσης χωρίς εξέλιξη ήταν πανομοιότυπες 5,6 μήνες και στα δύο σκέλη. Το Belzutifan προκάλεσε επίσης υψηλότερο ποσοστό αντικειμενικής ανταπόκρισης (22% έναντι 4%), συμπεριλαμβανομένης της πλήρους ανταπόκρισης στο 3% έναντι καμίας στο σκέλος που έλαβε θεραπεία με everolimus.
Ενώ τα αποτελέσματα της συνολικής επιβίωσης «ήταν ανώριμα κατά την τρέχουσα ανάλυση, με το 59% των θανάτων που αναφέρθηκαν, δεν παρατηρήθηκε τάση προς βλάβη», σύμφωνα με τον FDA. Επιπλέον, «μια περιγραφική ανάλυση των αναφερόμενων από τους ασθενείς συμπτωμάτων και λειτουργικών αποτελεσμάτων υποστήριξε τη βελτιωμένη ανεκτικότητα της belzutifan σε σύγκριση με την everolimus».
Συνολικά, το 6% των ασθενών διέκοψε οριστικά τον αναστολέα του HIF-2α λόγω τοξικότητας.
Οι συχνές ανεπιθύμητες ενέργειες (ΑΕ) στους ασθενείς που έλαβαν θεραπεία με belzutifan περιλάμβαναν κόπωση, μυοσκελετικό πόνο, μείωση της αιμοσφαιρίνης, του νατρίου και των λεμφοκυττάρων και αύξηση της κρεατινίνης, του καλίου και των ηπατικών ενζύμων.
Σοβαρές ΑΕ εμφανίστηκαν στο 38% των ασθενών που έλαβαν belzutifan, συμπεριλαμβανομένης της υποξίας (7%), της αναιμίας (5%), της πνευμονίας (3,5%), της αιμορραγίας (3%) και της υπεζωκοτικής συλλογής (2,2%). Θανατηφόρες ανεπιθύμητες ενέργειες εμφανίστηκαν στο 3,2% των ασθενών που έλαβαν Βelzutifan, συμπεριλαμβανομένων της σήψης και της αιμορραγίας (0,5% έκαστη).
Η ετικέτα του φαρμάκου περιέχει προειδοποίηση ότι η έκθεση σε Βelzutifan κατά τη διάρκεια της εγκυμοσύνης μπορεί να προκαλέσει βλάβη στο έμβρυο και ότι το φάρμακο μπορεί να καταστήσει αναποτελεσματικά ορισμένα ορμονικά αντισυλληπτικά. Άλλες προειδοποιήσεις περιλαμβάνουν κινδύνους για υποξία και αναιμία. Το belzutifan αντενδείκνυται για ασθενείς που λαμβάνουν αναστολείς του UGT2B17 ή του CYP2C19.