Όταν η Lisa Dutton ενημερώθηκε το 2017 ότι είχε απαλλαγεί από τον καρκίνο του μαστού, πήρε μια στιγμή για να το γιορτάσει με την οικογένεια και τους φίλους της, παρότι γνώριζε ότι η διαδρομή της μπορεί να μην είχε τελειώσει. Έως και 1 στους 3 ανθρώπους των οποίων οι όγκοι του μαστού έχουν εξαλειφθεί βλέπουν τη νόσο να επιστρέφει, μερικές φορές ακόμη και μετά από δεκαετίες. Πολλοί άλλοι καρκίνοι είναι γνωστό ότι υποτροπιάζουν στα χρόνια μετά την αρχική θεραπεία, ορισμένοι με πολύ υψηλότερα ποσοστά.
Στο πλαίσιο της θεραπείας της, η Dutton είχε ενταχθεί σε μια κλινική δοκιμή που ονομαζόταν SURMOUNT. Η μελέτη αυτή θα την παρακολουθούσε για «κοιμισμένα» καρκινικά κύτταρα, τα οποία πολλοί ερευνητές θεωρούσαν πλέον ότι ίσως εξηγούσαν τουλάχιστον ένα μέρος των υποτροπών. Αυτά τα αδρανή καρκινικά κύτταρα διέφευγαν της αρχικής θεραπείας και μετακινούνταν σε άλλα σημεία του σώματος. Αντί να πολλαπλασιαστούν αμέσως και να σχηματίσουν όγκους, όπως συνέβαινε συνήθως στη μεταστατική νόσο, όπου τα κύτταρα εξαπλώνονται από τον αρχικό όγκο, τα αδρανή κύτταρα παρέμεναν «σε ύπνο». Ήταν κρυμμένα από το ανοσοποιητικό σύστημα και δεν διαιρούνταν ενεργά. Αργότερα, όμως, μπορούσαν να «ξυπνήσουν» και να δημιουργήσουν όγκους.
Αν και η Dutton καταλάβαινε ότι η θεραπεία της μπορεί να μην είχε εξαλείψει κάθε ίχνος καρκίνου, είπε ότι σοκαρίστηκε το 2020, όταν για πρώτη φορά βρέθηκαν αδρανή κύτταρα στον μυελό των οστών της.
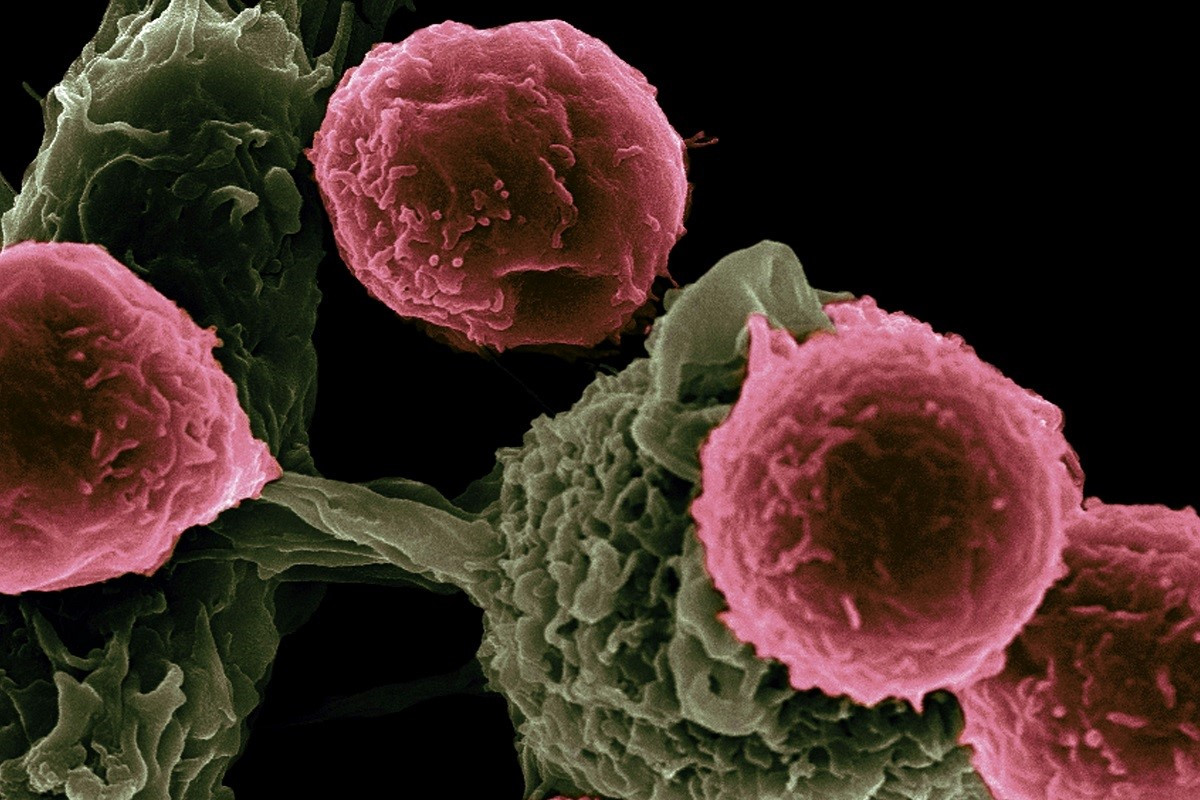
Οι ερευνητές εντόπισαν αδρανή καρκινικά κύτταρα, γνωστά και ως διασπαρμένα καρκινικά κύτταρα, ενώ τα κύτταρα αυτά ενοχοποιήθηκαν όλο και περισσότερο σε ορισμένες μεταστάσεις. Υπολογίστηκε ότι περίπου 30% των ανθρώπων που είχαν αντιμετωπιστεί επιτυχώς για καρκίνο μπορεί να «φιλοξενούσαν» τέτοια κύτταρα, αν και αδημοσίευτη εργασία υπέδειξε ότι ίσως ήταν ακόμη πιο συχνά.
Την τελευταία δεκαετία, μια σειρά προσπαθειών επιχείρησε να εντοπίσει και να κατανοήσει τα αδρανή κύτταρα, με τελικό στόχο να αντιμετωπιστούν θεραπευτικά. Πλέον, αρκετές κλινικές δοκιμές βρίσκονταν σε εξέλιξη για να ελέγξουν πιθανές θεραπείες.
Αν και η πρώτη δοκιμή στην οποία συμμετείχε η Dutton παρακολουθούσε μόνο τα κύτταρα, στη συνέχεια εντάχθηκε σε μια δεύτερη, που ονομαζόταν CLEVER, η οποία στόχευε να τα εξαλείψει. Καθώς τέτοιες δοκιμές προχωρούσαν, ανοιχτά ερωτήματα για τα «κοιμισμένα» κύτταρα, όπως τι προκαλούσε την αδράνεια και πώς μπορούσε να αντιμετωπιστεί, τράβηξαν περισσότερους ερευνητές στον τομέα.
«Αρχίσαμε να βλέπουμε πολλές ομάδες να συγκλίνουν σε παρόμοιες ιδέες, κάτι που ήταν πάντα πολύ ενθαρρυντικό», ανέφερε ο Cyrus Ghajar, βιολόγος καρκίνου στο Fred Hutchinson Cancer Center στο Σιάτλ, στην Ουάσινγκτον. Πρόσθεσε ότι οι δοκιμές που βρίσκονταν σε εξέλιξη ήταν «μαρτυρία του πόση πρόοδος έχει γίνει».
Μια σιωπηλή απειλή
Η ύπαρξη αδρανών καρκινικών κυττάρων προτάθηκε σαν ιδέα ήδη από τη δεκαετία του 1930, όταν ο Αυστραλός παθολογοανατόμος Rupert Willis απέδωσε ορισμένες δευτερογενείς καρκινικές αναπτύξεις σε τέτοια κύτταρα. Καθώς οι άνθρωποι που είχαν αντιμετωπιστεί για καρκίνο άρχισαν να ζουν περισσότερο, εκείνος και άλλοι παρατήρησαν ότι η νόσος μερικές φορές επέστρεφε πολύ αργότερα και συχνά ήταν ακόμη πιο επιθετική. Παρά αυτή την πρώιμη υπόθεση, η ιδέα της αδράνειας δεν κέρδισε έδαφος για δεκαετίες.
Ο Lewis Chodosh, γιατρός και ερευνητής στο Πανεπιστήμιο της Πενσυλβάνια στη Φιλαδέλφεια, θυμήθηκε ότι αντιμετώπισε αντίσταση όταν άρχισε να συζητά την ιδέα με συναδέλφους του πριν από περισσότερα από 20 χρόνια. Κανείς δεν ήθελε να πιστέψει ότι φάρμακα που σκότωναν τον καρκίνο μπορεί να άφηναν «κάτι πίσω», είπε, ενώ και οι φαρμακευτικές εταιρείες δεν ενδιαφέρθηκαν να αναπτύξουν θεραπείες για ανθρώπους που φαίνονταν να είχαν ιαθεί. Πολλοί επιστήμονες τότε υποστήριξαν ότι οι καρκίνοι που επανεμφανίζονταν θα έπρεπε να ήταν νέοι και όχι συνδεδεμένοι με παλαιότερες διαγνώσεις.
«Μόνο όταν συσσωρεύτηκαν αρκετές αποδείξεις, αναγκαστήκαμε να βγούμε από αυτόν τον τρόπο σκέψης», είπε ο Chodosh, ο οποίος συμμετείχε ως συν ερευνητής στις μελέτες SURMOUNT και CLEVER μαζί με την Angela DeMichele, ιατρό ογκολόγο στην Ιατρική Σχολή Perelman του Πανεπιστημίου της Πενσυλβάνια.
Χρησιμοποιώντας μια σειρά από κυτταρικούς δείκτες, οι ερευνητές ταυτοποίησαν αδρανή καρκινικά κύτταρα σε πολλά σημεία του σώματος. Οι δείκτες αυτοί βοήθησαν να φανεί όχι μόνο αν τα κύτταρα αναπτύσσονταν και διαιρούνταν, αλλά και από πού προέρχονταν, άρα και με ποιον τύπο καρκίνου σχετίζονταν. Οι μέθοδοι δεν ήταν τέλειες και οι ερευνητές συνέχισαν να εξετάζουν αν ορισμένα κύτταρα ήταν πιο πιθανό να «πέσουν» σε αδράνεια από άλλα και ποια χαρακτηριστικά τα όριζαν.
Ο Ghajar και άλλοι διαπίστωσαν ότι τα αδρανή κύτταρα εγκατέλειπαν τον πρωτογενή όγκο νωρίς στην πορεία του καρκίνου, συχνά πριν ακόμη γίνει διάγνωση. Το πώς και το γιατί αποσπώνταν δεν ήταν απολύτως σαφές, αλλά αφού περνούσαν λίγα μόλις λεπτά στην κυκλοφορία, έβγαιναν από την κυκλοφορία του αίματος και συγκεντρώνονταν σε συγκεκριμένα σημεία του σώματος, όπως ο μυελός των οστών και οι λεμφαδένες. Ακόμη και σε αυτές τις «φωλιές», τα αδρανή κύτταρα ήταν εξαιρετικά σπάνια, μόλις λίγα ανάμεσα σε εκατομμύρια υγιή κύτταρα. Η κατάσταση «αναστολής» τα προστάτευε από συμβατικές θεραπείες, όπως η χημειοθεραπεία, που στόχευε τα ταχέως διαιρούμενα κύτταρα.
Ο Petros Tsantoulis, ιατρός ογκολόγος στο Πανεπιστήμιο της Γενεύης, είπε ότι η αδράνεια διέφερε από άλλες γνωστές καταστάσεις, όπως η κυτταρική γήρανση, όπου τα γηρασμένα κύτταρα σταματούσαν να διαιρούνται καθώς προετοιμάζονταν να πεθάνουν. Υπό τις κατάλληλες συνθήκες, τα αδρανή κύτταρα μπορούσαν να αρχίσουν ξανά να διαιρούνται. Μόλις επανενεργοποιούνταν, πολλαπλασιάζονταν σε όγκους που αναπαρήγαγαν όλη την πολυπλοκότητα του αρχικού όγκου.
Αυτό οδήγησε ορισμένους ερευνητές να προτείνουν ότι τα αδρανή καρκινικά κύτταρα μπορεί να ήταν καρκινικά βλαστοκύτταρα, ένας τύπος κυττάρου που μέσω ανανέωσης και διαφοροποίησης μπορούσε να δώσει γένεση στον όγκο, ή τουλάχιστον καρκινικά κύτταρα με βλαστοκυτταρικά χαρακτηριστικά.
Τα αδρανή κύτταρα εμφάνισαν ορισμένα στοιχεία που συνδέθηκαν συχνά με τα βλαστοκύτταρα, όπως υπερέκφραση συγκεκριμένων γονιδίων. Ο Joan Massagué, διευθυντής του Sloan Kettering Institute στη Νέα Υόρκη, ανέφερε ότι τα βλαστοκύτταρα περνούσαν το μεγαλύτερο μέρος του χρόνου τους σε αδράνεια και «ξυπνούσαν» μόνο μετά από τραυματισμό ή ασθένεια, κάτι που τα έκανε προφανείς υποψηφίους. Παρ’ όλα αυτά, η ύπαρξη καρκινικών βλαστοκυττάρων παρέμεινε αμφιλεγόμενη.
Οι επιστήμονες φάνηκαν έτοιμοι να απαντήσουν σύντομα σε αρκετά από αυτά τα ανοιχτά ερωτήματα. Με προηγμένες τεχνικές που επέτρεπαν τη μελέτη μεμονωμένων κυττάρων με μεγαλύτερη ακρίβεια, έγινε δυνατό να εντοπίζονται, να απομονώνονται και να εμπλουτίζονται αδρανή καρκινικά κύτταρα για περαιτέρω μελέτη. Η ομάδα των Chodosh και DeMichele, για παράδειγμα, ανέπτυσσε μια δοκιμασία για την ανίχνευση αδρανών κυττάρων. Ο Chodosh είπε ότι ήταν πολύ πιο ευαίσθητη από τις υπάρχουσες προσεγγίσεις και θα μπορούσε τελικά να βελτιώσει τις εκτιμήσεις για το πόσοι άνθρωποι έφεραν τέτοια κύτταρα.
Ο Ghajar, από την άλλη, κατέληξε σε διαφορετικό τρόπο σκέψης για αυτά τα κύτταρα. Αν ένα αδρανές κύτταρο από όγκο μαστού κατέληγε στον μυελό των οστών, θα περίμενε κανείς να διατηρούσε χαρακτηριστικά ενός καρκινικού κυττάρου μαστού που θα το έκαναν αναγνωρίσιμο. «Αυτό που βρίσκουμε είναι ότι αυτές οι προσδοκίες δεν επιβεβαιώθηκαν», είπε, εξηγώντας ότι όταν ένα καρκινικό κύτταρο εξαπλωνόταν, συχνά άλλαζε σχήμα, μέγεθος και συμπεριφορά. «Θα χρειαστεί να πάμε πέρα από έναν ορισμό που βασίζεται σε κοινά χαρακτηριστικά και να χαρτογραφήσουμε τις μεταλλάξεις αυτών των κυττάρων σε σχέση με τις μεταλλάξεις του αρχικού όγκου, ώστε να ορίζουμε ένα διασπαρμένο κύτταρο όχι από το πώς νομίζουμε ότι θα έπρεπε να μοιάζει, αλλά από το τι μας λέει το γονιδίωμά του», πρόσθεσε.
Σήματα ύπνου και αφύπνισης
Πέρα από τον ορισμό της αδράνειας, οι ερευνητές ήθελαν να κατανοήσουν πώς και γιατί τα κύτταρα έμπαιναν σε αδράνεια και ποιοι παράγοντες τα επανενεργοποιούσαν.
Σύμφωνα με τη Judith Agudo, ανοσολόγο στο Dana Farber Cancer Institute στη Βοστώνη, τα κύτταρα πιθανότατα έμπαιναν σε αδράνεια ως μηχανισμό προστασίας. Ως μέρος ενός όγκου, μεμονωμένα κύτταρα μπορεί να ήταν πιο προστατευμένα από το ανοσοποιητικό σύστημα, αλλά μόλις έμεναν μόνα τους, «μπορούσαν εύκολα να εξοντωθούν αν δεν έκαναν κινήσεις για να κρυφτούν», είπε. Επιπλέον, το ταξίδι μέσα στο σώμα προς μια νέα «φωλιά» ήταν στρεσογόνο και σκότωνε τη συντριπτική πλειονότητα των κυττάρων που αποσπώνταν. Η αδράνεια ήταν ένας τρόπος να επιβίωναν σε ένα σκληρό περιβάλλον.
Έρευνα έδειξε ότι όσο τα κύτταρα «κοιμούνταν», συνέχιζαν να επικοινωνούν με το μικροπεριβάλλον τους και να αλλάζονταν ώστε να διατηρούσαν ενεργά την αδράνεια. Για παράδειγμα, τα αδρανή κύτταρα φαίνεται ότι μετέβαλλαν την έκφραση γονιδίων που σχετίζονταν με την επιβίωση, συμπεριλαμβανομένης της οδού mTOR, ενός κεντρικού ρυθμιστή του κυτταρικού μεταβολισμού και της ανάπτυξης. Τα κύτταρα αξιοποιούσαν επίσης την αυτοφαγία, μια μορφή «αυτοανακύκλωσης», που τους επέτρεπε να επαναχρησιμοποιούσαν εσωτερικούς πόρους και να επιβίωναν με ελάχιστη υποστήριξη από το περιβάλλον τους.
Η σχέση τους με το εξωτερικό περιβάλλον ήταν σύνθετη και περιλάμβανε και το ανοσοποιητικό σύστημα. Ο Julio Aguirre Ghiso, ιδρυτικός διευθυντής του Cancer Dormancy Institute στο Montefiore Einstein Comprehensive Cancer Center στη Νέα Υόρκη, ανέφερε ότι η ανοσολογική απόκριση ενεπλάκη όχι μόνο στην πρόκληση της αδράνειας αλλά και στη διατήρηση και τη λήξη της.
Η ομάδα του έδειξε ότι μακροφάγα στους πνεύμονες παρήγαγαν μια συγκεκριμένη πρωτεΐνη, η οποία συνδεόταν με αδρανή κύτταρα καρκίνου του μαστού και ενίσχυε την αδράνειά τους. Άλλη έρευνα έδειξε πώς τα αδρανή κύτταρα απέφευγαν την επιτήρηση από κύτταρα του ανοσοποιητικού, συμπεριλαμβανομένων των Τ κυττάρων και των φυσικών φονικών κυττάρων.
Συνολικά, τα δεδομένα υπέδειξαν ότι τα κύτταρα συνήθως παρέμεναν αδρανή έως ότου το ανοσολογικό «τοπίο» διαταρασσόταν με κάποιον τρόπο, μετατοπίζοντας την ισορροπία αρκετά ώστε τα κύτταρα να μπορούσαν να επανενεργοποιηθούν με μεγαλύτερη ασφάλεια. Τέτοιες μεταβολές μπορεί να αφορούσαν τραυματισμό ή ασθένεια, με μελέτες των τελευταίων ετών να έχουν συνδέση την κυτταρική βλάβη, καθώς και λοιμώξεις από COVID 19 και γρίπη, με την έξοδο των καρκινικών κυττάρων από την αδράνεια. Η γήρανση, η ίνωση, το χρόνιο στρες ή ο τρόπος ζωής μπορεί επίσης να συνέβαλαν στην επανενεργοποίηση.
«Για τα κύτταρα, ήταν παιχνίδι πιθανοτήτων», είπε η Shelly Peyton, βιοϊατρική μηχανικός στο Πανεπιστήμιο Tufts στο Medford της Μασαχουσέτης. Τα κύτταρα «προσπαθούσαν συνεχώς να βγουν από την αδράνεια μετά από μικρές διαταραχές, μόνο και μόνο για να σκοτωθούν». «Όμως σε στιγμές που η ισορροπία διαταρασσόταν ουσιαστικά, τότε συχνά βλέπαμε τη μετάσταση να απογειώνεται», πρόσθεσε.
Η έρευνα της Peyton εστίασε στην ίνωση, δηλαδή τη συσσώρευση ινώδους συνδετικού ιστού σε σημείο βλάβης. Αυτό συχνά συσχετίστηκε με τον καρκίνο, επειδή η αυξημένη «σκληρότητα» βοηθούσε τον όγκο να αναπτυχθεί και διευκόλυνε την επικοινωνία μεταξύ κυττάρων. Ο μυελός των οστών, όπου συχνά εντοπίζονταν αδρανή κύτταρα, ήταν μαλακός και η Peyton διερεύνησε αν αυτό το μαλακό περιβάλλον μπορεί να ήταν ένας παράγοντας που ενίσχυε την αδράνεια. Είπε ότι ήταν πιθανό η φυσιολογική, ηλικιακή απώλεια οστικής πυκνότητας, δηλαδή η οστεοπόρωση, ή οι ορμονικές αλλαγές σε γυναίκες που είχαν στο παρελθόν καρκίνο του μαστού να προκαλούσαν ίνωση και ενδεχομένως επανενεργοποίηση του καρκίνου.
Πιθανές λύσεις
Το 2018, οι προσπάθειες να βρεθούν θεραπείες για τα αδρανή κύτταρα έλαβαν ρυθμιστική ώθηση, όταν ο Οργανισμός Τροφίμων και Φαρμάκων των ΗΠΑ διεύρυνε το πλαίσιο των αντικαρκινικών θεραπειών ώστε να περιλαμβάνει όχι μόνο θεραπείες που συρρίκνωναν όγκους, αλλά και θεραπείες που απέτρεπαν ή καθυστερούσαν την ανάπτυξη δευτερογενών όγκων. Οι περισσότερες ομάδες που στόχευσαν την αδράνεια επιδίωξαν να προλάβουν την υποτροπή σκοτώνοντας τα αδρανή κύτταρα εκεί όπου βρίσκονταν.
Μια προσέγγιση ήταν να γίνουν ορατά στα ανοσοποιητικά κύτταρα που περνούσαν από κοντά. Ο Ghajar, για παράδειγμα, θεώρησε ότι ο λόγος που τα αδρανή κύτταρα παρέμεναν κρυμμένα δεν ήταν μια εξελιγμένη στρατηγική ανοσοδιαφυγής, αλλά το ότι δεν έρχονταν σε επαφή με αρκετά Τ κύτταρα. Η ομάδα του διερεύνησε αν θεραπεία με CAR T κύτταρα, γενετικά τροποποιημένες εκδοχές των ανοσοποιητικών κυττάρων του ίδιου του ατόμου, μπορούσε να αυξήσει την πιθανότητα τα ανοσοποιητικά κύτταρα να «πέσουν πάνω» σε αδρανή καρκινικά κύτταρα.
Άλλοι στόχευσαν τις σηματοδοτικές και μεταβολικές οδούς που χρησιμοποιούσαν τα καρκινικά κύτταρα για να επιβίωναν. Θεραπείες που στόχευσαν ενεργά καρκινικά κύτταρα μέσω μηχανισμών που δεν εξαρτώνταν από την κυτταρική διαίρεση ίσως ήταν αποτελεσματικές και απέναντι στα αδρανή καρκινικά κύτταρα.
Ο Aguirre Ghiso στόχευσε οδούς που επέτρεπαν στα κύτταρα να επιβίωναν σε εχθρικά περιβάλλοντα, τονίζοντας ότι τόσο τα ενεργά όσο και τα αδρανή κύτταρα βασίζονταν σε παρόμοιους μηχανισμούς για να επέμεναν σε σημεία όπου κανονικά δεν θα έπρεπε να βρίσκονταν.
Συνίδρυσε μια εταιρεία που ονομαζόταν HiberCell στη Νέα Υόρκη, η οποία ανέπτυξε ένα μόριο που ανέστειλε το ένζυμο PERK. Το ένζυμο αυτό εμπλεκόταν στην ικανότητα ενός κυττάρου να επέστρεφε σε σταθερή κατάσταση μετά από ένα στρεσογόνο ερέθισμα, στο πλαίσιο της λεγόμενης ολοκληρωμένης απόκρισης στο στρες. Ο αναστολέας του PERK διέκοπτε αυτή την απόκριση όσο χρειαζόταν ώστε να οδηγούσε τα κύτταρα στον θάνατο.
Με βάση προκλινικά αποτελέσματα, ο FDA έδωσε ταχεία διαδικασία αξιολόγησης στον αναστολέα ως θεραπεία για τον καρκίνο του στομάχου και άλλους συμπαγείς όγκους και η ομάδα ολοκλήρωσε μια δοκιμή φάσης Ι το 2023. Αν και η δοκιμή εστίασε γενικά σε καρκινικά κύτταρα, ο Aguirre Ghiso ανέφερε ότι η ομάδα διερευνούσε την αποτελεσματικότητα του μορίου απέναντι σε αδρανή καρκινικά κύτταρα στους πνεύμονες και στον μυελό των οστών σε ζωικά μοντέλα.
Ίσως οι μεγαλύτερες εξελίξεις να προήλθαν από προσπάθειες να μπλοκαριστεί η αυτοφαγία, περιορίζοντας την ικανότητα των αδρανών κυττάρων να «ανακυκλώνουν» τον εαυτό τους. «Επειδή αυτά τα κύτταρα χρειάζονταν πολύ λίγα για να επιβίωναν, η στέρηση ακόμη και ενός μικρού ποσού μπορούσε να αρκούσε για να τα οδηγήσει σε μια σπειροειδή κατάρρευση», είπε η Robin Anderson, ερευνήτρια καρκίνου του μαστού στο Olivia Newton John Cancer Research Institute στη Χαϊδελβέργη της Αυστραλίας.
Η διαταραχή της αυτοφαγίας αποτέλεσε τον στόχο της δοκιμής CLEVER φάσης ΙΙ, στην οποία συμμετείχε η Dutton, καθώς και τη βάση δύο ακόμη μελετών που επέβλεπαν η DeMichele και ο Chodosh. Οι 3 δοκιμές εξέτασαν την αποτελεσματικότητα της υδροξυχλωροκίνης, ενός φαρμάκου που ανέστειλε την αυτοφαγία, είτε μόνης είτε σε συνδυασμό με άλλες θεραπείες. Σε αυτές περιλαμβάνονταν φάρμακα που διέκοπταν τη σηματοδότηση mTOR, παράγοντες που μπλόκαραν τον κυτταρικό πολλαπλασιασμό και ανοσοθεραπείες που «ξεσκέπαζαν» τα καρκινικά κύτταρα ώστε να γίνονταν ορατά στο ανοσοποιητικό σύστημα.
Στη δοκιμή CLEVER, περίπου 50 άτομα με καρκίνο του μαστού έλαβαν υδροξυχλωροκίνη, είτε μόνη είτε μαζί με το everolimus, ένα φάρμακο που διέκοπτε τη σηματοδότηση mTOR. Όσοι έλαβαν μόνο υδροξυχλωροκίνη ή μόνο everolimus είδαν μείωση των αδρανών καρκινικών κυττάρων, αλλά το αποτέλεσμα ήταν πιο ισχυρό σε όσους έλαβαν τον συνδυασμό. Η υδροξυχλωροκίνη και το everolimus μαζί εξάλειψαν τα αδρανή καρκινικά κύτταρα στο 87% των συμμετεχόντων μετά από 6 έως 12 μήνες.
Η DeMichele ανέφερε ότι ο στόχος ήταν να εντοπιστεί ο ιδανικός «συνδυασμός» φαρμάκων πριν ξεκινούσε μια δοκιμή με το ισχυρότερο σχήμα. Ωστόσο, σημείωσε ότι η αδράνεια πιθανότατα δεν θα λυνόταν με μία μόνο προσέγγιση. Διάφορες θεραπείες βρίσκονταν υπό διερεύνηση, καθώς οι ερευνητές μάθαιναν περισσότερα για την αδράνεια και αναγνώριζαν την πολυπλοκότητά της. «Φαίνεται ότι θα καταλήγαμε με μια μεγαλύτερη εργαλειοθήκη, από την οποία θα επιλέγαμε ανάλογα με τον ασθενή», είπε η DeMichele.
Με πληροφορίες από το περιοδικό Nature.